Analisi Dei Rischi - ISO 14971 - Risk File
Per soddisfare le esigenze degli standard internazionali e garantire che la Vostra azienda introduca un prodotto sicuro, efficace nel mercato nei tempi e con i budget previsti, è necessaria la corretta implementazione del sistema di gestione del rischio. Possiamo assistere e aiutare la vostra azienda a farlo nel modo giusto.
Nel settore dei dispositivi medici, la gestione del rischio va oltre lo sviluppo e la produzione; è una parte vitale di tutti i processi della vostra azienda. La ISO 14971 definisce i requisiti internazionali dei sistemi di gestione dei rischi per i dispositivi medici, la definizione di migliori pratiche in tutta l'intero ciclo di vita di un dispositivo.
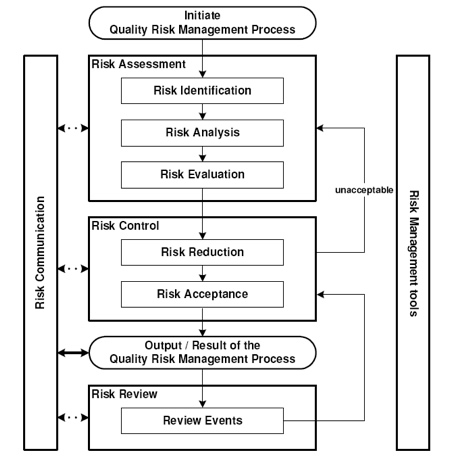
Panoramica di un processo di gestione dei rischi (fonte: GMP allegato 20)
Il produttore, a fronte di 93/42 CEE è tenuto ad effettuare un'analisi dei rischi al fine di evitare o ridurre al minimo la possibilità di incidenti.
ISO 14971: 2007 specifica un processo per un fabbricante di individuare i rischi connessi con i dispositivi medici, per stimare e valutare i rischi associati, di controllare questi rischi, e per monitorare l'efficacia dei controlli. A seguito di alcune definizioni importanti per la comprensione del processo di risk management:
Richiedi info