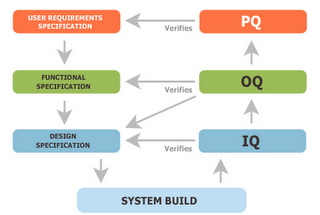
Validazione DQ IQ OQ PQ
Eseguiamo convalide di processo con metodologia IQ OQ PQ in ottemperanza alle norme cGMP.
L'Annex 15 del EU GMP fornisce le linee guida per IQ OQ PQ convalida. Tutte le attività di convalida devono essere pianificate. Gli elementi chiave di un programma di convalida devono essere chiaramente definiti e documentati in un piano generale di convalida (VMP) o documenti equivalenti.
Il VMP deve essere un documento di sintesi, breve, conciso e chiaro. Il VMP deve contenere dati almeno i seguenti:
(a) validation policy;
(b) organisational structure of validation activities;
(c) summary of facilities, systems, equipment and processes to be validated;
(d) documentation format: the format to be used for protocols and reports;
(e) planning and scheduling;
(f) change control;
(g) reference to existing documents.
 Forniamo supporto nei seguenti ambiti:
Forniamo supporto nei seguenti ambiti:
- Convalida Processi di Sterilizzazione
- Convalida Processi di Lavaggio
- Convalida Processi Produzione Farmaceutica
- Convalida Trattamenti Superficiali
- Convalida Processo Stampaggio ad Iniezione
- Convalida Processi Speciali
Richiedi info